Linia SOLCRYS w NCPS SOLARIS będzie oferowała rutynowe badania struktury białek z wykorzystaniem dyfrakcji promieniowania synchrotronowego. Obecnie postęp w dziedzinie biologii strukturalnej opiera się na współistnieniu 3 głównych technik badawczych: krystalografii makrocząsteczkowej, mikroskopii krioelektronowej pojedynczych cząsteczek oraz spektroskopii magnetycznego rezonansu jądrowego. Krystalografia makromolekuł jest jednak nadal główną metodą określania struktury przestrzennej białek i ich kompleksów. Synchrotronowe linie pomiarowe dedykowane krystalografii białek znajdują się w prawie wszystkich synchrotronach na świecie. Prowadzone są na nich badania strukturalne z wykorzystaniem technik krystalografii seryjnej lub badania przesiewowe kompleksów białkowych ze związkami o potencjalnym znaczeniu medycznym. Pomimo intensywnego rozwoju mikroskopii krioelektronowej, badanie struktury kompleksów białek z kwasami nukleinowymi lub innymi białkami nadal znajduje się w centrum zastosowań krystalografii białek. Struktury kompleksów wielkocząsteczkowych dostarczają informacji nie tylko o architekturze molekularnej, ale także o oddziaływaniach pomiędzy makrocząsteczkami.
Przykładem badań kompleksów wielkocząsteczkowych prowadzonych z wykorzystaniem dyfrakcji promieniowania synchrotronowego jest struktura kompleksu mitochondrialnego RNA degradosomu z Candidia glabrata, składającego się z 2 podjednostek - nukleazy i helikazy [1]. Enzymy te odgrywają kluczową rolę w przetwarzaniu i degradacji RNA. Eksperymenty dyfrakcyjne przeprowadzono w European Synchrotron Radiation Facility (Grenoble, Francja) na linii badawczej ID23-2.
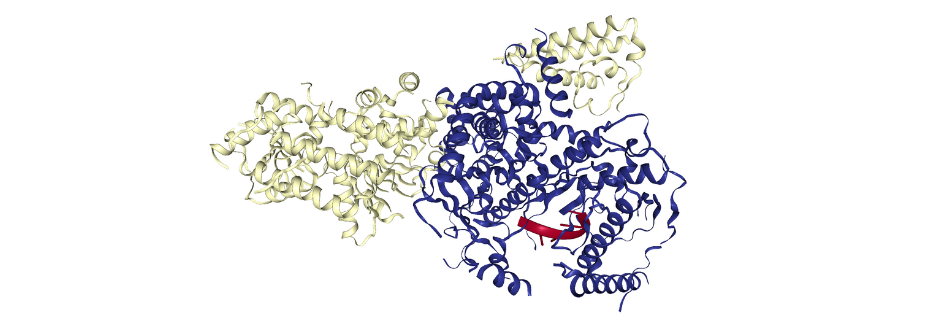
Rysunek 1. Struktura przestrzenna kompleksu mitochondrialnego RNA degradosomu drożdży mtEXO (PDB ID: 6F4A). Kompleks mtEXO składa się z nukleazy (żółty) i helikazy (niebieski) z krótkim fragmentem RNA (czerwony).
Krystalografia makromolekularna jest często wykorzystywana do charakteryzowania enzymów i ich strukturalnych homologów. W połączeniu z bioinformatyką i innymi technikami eksperymentalnymi, możliwe jest śledzenie ewolucji białek w różnych organizmach. Przykładem takich badań, wykonanych na liniach SBC-CAT 19-ID i LS-CAT 21-ID-F w Advanced Photon Source (Argonne, USA) jest prezentacja struktur krystalicznych dwóch dihydroorotaz z Yersinia pestis i Vibrio cholerae [2]. Dihydroorotazy są enzymami szlaku biosyntezy pirymidyn de novo, które odgrywają kluczową rolę w proliferacji bakterii. Dzięki możliwości zmiany długości fali na linii badawczej możliwe było scharakteryzowanie metalu związanego w miejscu aktywnym białka (Rys. 2).
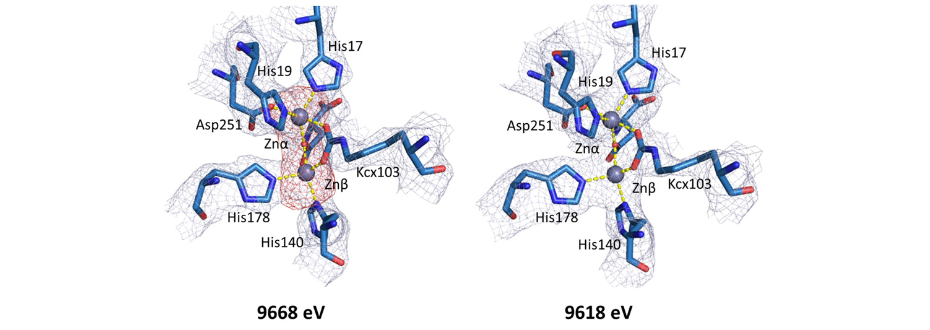
Rys. 2. Porównanie map gęstości elektronowej w rejonach miejsca aktywnego YpDHO (PDB ID: 6CTY) obliczonych dla zestawów danych zebranych przy energiach powyżej (9668 eV) i poniżej krawędzi absorpcji cynku (9618 eV). Poniżej krawędzi absorpcji cynku, pik anomalnej mapy gęstości (czerwony) odpowiadający pozycji metalu cynku całkowicie zanika. [2]
[1] M. Razew et al., Structural Analysis of MtEXO Mitochondrial RNA Degradosome Reveals Tight Coupling of Nuclease and Helicase Components, Nat Commun 9, 97 (2018).
[2] J. Lipowska, C. D. Miks, K. Kwon, L. Shuvalova, H. Zheng, K. Lewiński, D. R. Cooper, I. G. Shabalin, and W. Minor, Pyrimidine Biosynthesis in Pathogens – Structures and Analysis of Dihydroorotases from Yersinia Pestis and Vibrio Cholerae, Int J Biol Macromol 136, 1176 (2019).

